ALTER
Essai de phase II, multicentrique, randomisé, ouvert, évaluant la combinaison sacituzumab-govitecan et trastuzumab-deruxtecan dans un schéma alternatif pour les patientes atteintes d’un cancer du sein métastatique ou localement avancé triple négatif Her2 faible
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Etablissement(s) participant(s)
Dr Alexandre TASSIN DE NONNEVILLE
Détails de l'essai
Objectif principal
Démontrer la supériorité, en termes de survie globale, des combinaisons SG et T-DXd dans un schéma d’alternance en première ligne de conjugués anticorps-médicaments dans le cas d’un cancer du sein métastatique HER2 faible, par rapport au SG seul.
Objectif(s) secondaire(s)
Efficacité :
• Comparer le taux de bénéfice clinique (CBR) entre le schéma de traitement alterné et le sacituzumab govitecan en monothérapie.
• Comparer le taux de réponse objective (ORR) entre le schéma de traitement alterné et le sacituzumab govitecan en monothérapie.
• Comparer la survie sans progression (PFS) entre le schéma de traitement alterné et le sacituzumab govitecan en monothérapie.
• Comparer la survie sans progression ajustée selon la qualité de vie (QA-PFS) entre le schéma de traitement alterné et le sacituzumab govitecan en monothérapie.
• Décrire la pharmacocinétique et la pharmacodynamique des ADC dans le cadre du schéma alternatif.
Sécurité et qualité de vie :
• Évaluer la sécurité et la tolérabilité du schéma de traitement alterné comparativement au bras contrôle (sacituzumab govitecan en monothérapie).
• Comparer la qualité de vie entre le schéma de traitement alterné (sacituzumab govitecan et trastuzumab deruxtecan) et le SG en monothérapie.
Résumé / schéma de l'étude
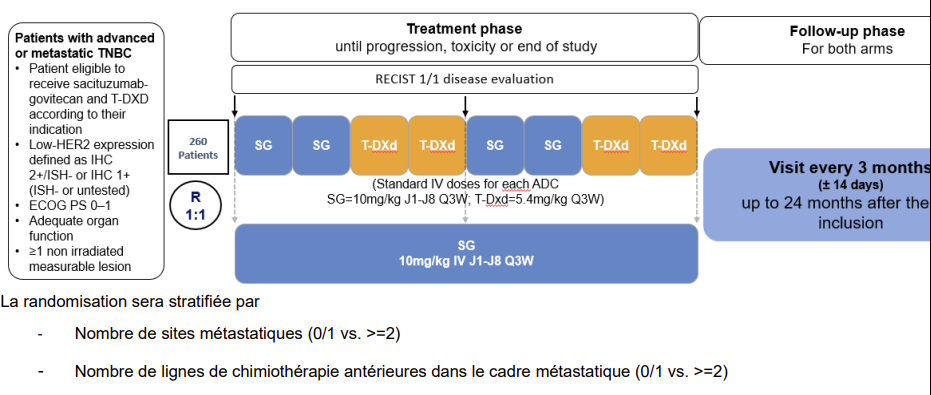
Critère(s) d'inclusion
- Le patient doit avoir signé un consentement éclairé écrit avant toute procédure spécifique à l’essai.
Note : Lorsque le patient est physiquement incapable de donner son consentement écrit, un témoin impartial de son choix, indépendant de l’investigateur ou du sponsor, peut confirmer la signature du consentement du patient. - Hommes ou femmes âgés de ≥ 18 ans.
- Cancer du sein triple négatif histologiquement confirmé, métastatique ou localement avancé et non résécable, qui répond aux deux critères suivants par un test local :
- Cancer du sein HER2 faible avec preuve documentée de HER2 faible définie comme : [immunohistochimie (IHC) 2+/hybridation in situ (ISH) – ou IHC 1+ (ISH- ou non testé)] sur le site primaire ou sur tout site métastatique.
- Avec une expression des récepteurs d’œstrogènes <10% ET une expression des récepteurs de progestérone <10%,
Remarque : Dans le cadre du protocole, une femme est considérée comme étant en âge de procréer, c’est-àdire fertile, à partir de la ménarche et jusqu’à la ménopause, sauf en cas de stérilité permanente. Les méthodes de stérilisation permanente comprennent l’hystérectomie, la salpingectomie bilatérale et l’ovariectomie bilatérale. L’état postménopausique est défini par l’absence de menstruations pendant 12 mois sans autre cause médicale. Un taux élevé d’hormone folliculo-stimulante (FSH) dans la plage postménopausique peut être utilisé pour confirmer l’état postménopausique chez les femmes n’utilisant pas de contraception hormonale ni de traitement hormonal substitutif. Cependant, en l’absence d’aménorrhée depuis 12 mois, une seule mesure de la FSH est insuffisante.
- Patient éligible pour recevoir le sacituzumab-govitecan et le T-Dxd selon leur indication.
- Statut de performance de l’Eastern Cooperative Oncology Group (ECOG) ≤1.
- Les femmes en âge de procréer et les patients masculins doivent accepter d’utiliser une contraception adéquate pendant toute la durée de la participation à l’essai et jusqu’à 7 mois après la fin du traitement de l’étude pour les femmes et jusqu’à 4 mois pour les hommes.
Note : Une femme est considérée comme étant en âge de procréer si elle n’est pas ménopausée ou si elle n’a pas subi d’hystérectomie. La ménopause est définie comme suit
– Âge ≥60 ans
– Âge <60 ans et ≥12 mois continus d’aménorrhée sans cause identifiée autre que la ménopause.
– Stérilisation chirurgicale (ovariectomie bilatérale). - Fonctionnement adéquat des organes et de la moelle osseuse dans les 28 jours précédant l’inscription. Pour tous les paramètres énumérés ci-dessous, les résultats les plus récents disponibles doivent être utilisés.
- Hémoglobine ≥ 9 g/dL. Remarque : la transfusion de globules rouges n’est pas autorisée dans la semaine précédant l’évaluation de dépistage.
- Numération absolue des neutrophiles (ANC) ≥ 1500/mm3
Remarque : l’administration de facteur stimulant les colonies de granulocytes (G-CSF) n’est pas autorisée dans la semaine précédant l’évaluation de dépistage. - Numération plaquettaire ≥ 100 000/mm3
Remarque : la transfusion de plaquettes n’est pas autorisée dans la semaine précédant l’enregistrement. - Bilirubine totale ≤ 1,5 × la limite supérieure de la normale (LSN) en l’absence de métastases hépatiques ou < 3 × LSN en présence d’un syndrome de Gilbert documenté (hyperbilirubinémie non conjuguée) ou de métastases hépatiques au départ.
- Alanine transaminase (ALT) et aspartate aminotransférase (AST) ≤ 3 × ULN ou < 5 × ULN chez les patients présentant des métastases hépatiques.
- Albumine sérique ≥ 2,5 g/dL.
- Clairance de la créatinine (ClCr) ≥ 30 ml/min (calculée à l’aide de l’équation de Cockcroft et Gault). Équation de Cockcroft-Gault : ClCr (ml/min) = [140 – âge (années)] × poids (kg) 72 × créatinine sérique (mg/dl) {× 0,85 pour les femmes}.
- Fonction cardiaque adéquate, définie par une fraction d’éjection du ventricule gauche ≥ 55 % estimée par échocardiographie ou scintigraphie à acquisition multiple.
- Les femmes en âge de procréer doivent avoir un test de grossesse sérique ou urinaire négatif dans les 7 jours précédant la randomisation.
- Affilié au système français de sécurité sociale (ou équivalent).
- Patient désireux et capable de se conformer au protocole pendant toute la durée de l’essai, y compris en ce qui concerne le traitement et les visites prévues, ainsi que les examens, y compris le suivi.
Critère(s) de non-inclusion
- Traitement antérieur par un ADC ciblant HER2 ou TROP2.
- Maladie cardiovasculaire non contrôlée ou importante.
- Patients présentant des métastases cérébrales (MC), à l’exception des MC traitées asymptomatiques ne nécessitant pas de traitement corticostéroïde continu et présentant des lésions stables sur l’IRM cérébrale de base/de dépistage. Les patients qui doivent être traités pour des métastases cérébrales sont éligibles 14 jours après la chirurgie ou la radiothérapie, s’ils sont considérés comme cliniquement stables et ne nécessitant pas de traitement corticostéroïde continu.
- Antécédents de pneumopathie interstitielle (non infectieuse) ou de pneumonie ayant nécessité l’administration de stéroïdes, ou pneumopathie interstitielle/pneumonite en cours, ou pneumopathie interstitielle/pneumonite suspectée qui ne peut être exclue par l’imagerie lors de la sélection.
- Tout antécédent médical ou condition qui, selon le protocole ou l’opinion de l’investigateur, est incompatible avec l’étude.
- Patients présentant une allergie connue ou une hypersensibilité grave à l’un des médicaments de l’essai ou à leurs excipients.
- Autres troubles médicaux ou psychiatriques concomitants qui, de l’avis de l’investigateur, peuvent induire en erreur l’interprétation de l’étude ou empêcher la réalisation des procédures de l’étude et des examens de suivi.
- Les patients souffrant de toute autre maladie ou affection nécessitant une hospitalisation ou incompatible avec le traitement de l’essai ne sont pas éligibles.
- Les patients participant à un autre essai thérapeutique dans les 30 jours précédant l’inclusion.
- Femmes enceintes ou allaitantes au moment de la randomisation ou ayant l’intention de tomber enceinte pendant l’étude et jusqu’à 7 mois après le traitement.
- Personnes privées de liberté ou placées sous protection ou tutelle.
- Les patients qui ne veulent pas ou ne peuvent pas se conformer au suivi médical requis par l’essai pour des raisons géographiques, familiales, sociales ou psychologiques.
Calendrier prévisionnel
Lancement de l’étude : Octobre 2025
Fin estimée des inclusions : Octobre 2027
Nombre de patients à inclure : 260
Coordonnateur de l'étude
Dr Alexandre TASSIN DE NONNEVILLE – Institut Paoli Calmettes – CLCC Marseille
Promoteur de l'étude
UNICANCER
