IMMUNORARE5
Plateforme nationale de 5 essais académiques de phase II coordonnés par le CHU de Lyon pour évaluer la tolérance et l’efficacité de l’immunothérapie avec l’association Domvanalimab + Zimberelimab chez les patients atteints de cancers rares avancés
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Etablissement(s) participant(s)
Dr Cécile VICIER
Pr Pascale TOMASINI
Détails de l'essai
Objectif principal
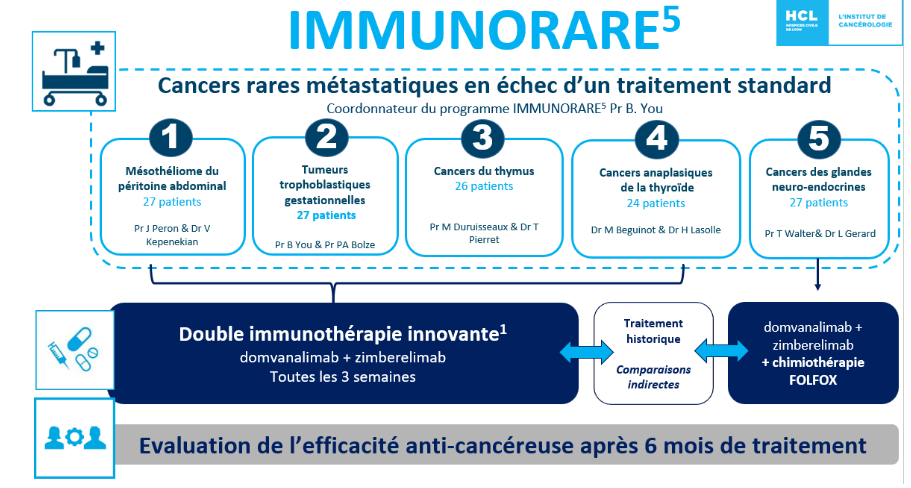
L’objectif principal est d’évaluer l’efficacité de l’association de Domvanalimab et de Zimberelimab en termes de survie sans progression taux de réponse à 24 semaines (pour les cohortes 1, 3, 5), taux de normalisation réussie de l’hCG (gonadotrophine chorionique humaine) à 24 semaines pour la cohorte 2 et taux de survie pour la cohorte 4.
Cohorte 1 : Mésothéliomes péritonéaux (MP)
Cohorte 2 : Tumeurs trophoblastiques gestationnelles (TGT)
Cohorte 3 : Thymomes B3 et carcinomes thymiques (TET)
Cohorte 4 : Carcinomes thyroïdiens réfractaires (ATC)
Cohorte 5 : TNE-GEP et tumeurs carcinoïdes (TNE-GEP (tumeurs neuroendocrines gastro-entéro-pancréatiques)/TCT (tumeur carcinoïde thoracique)/TNE-UP (tumeur neuroendocrine de primitif inconnu))
Objectif(s) secondaire(s)
Les objectifs secondaires sont d’évaluer l’efficacité de la combinaison d’immunothérapies anti-TIGIT (immunorécepteur des cellules T avec domaines Ig et ITIM) et anti-PD-1 (mort programmée-1) en termes de taux de réponse globale, de survie sans progression (cohortes 1-3 et 5), de survie sans résistance (cohorte 2), de survie globale (cohortes 1-3 et 5), de durée de la réponse (cohortes 1-3 et 5) ; et d’évaluer la tolérance du doublet d’immunothérapie en termes d’événements indésirables.
Résumé / schéma de l'étude
Critère(s) d'inclusion
Critères d’inclusions applicables à toutes les cohortes :
- Tumeurs solides avancées histologiquement prouvées, en progression/résistance après au moins une ligne de traitement systémique standard, ou en résistance pendant la première ligne de traitement.
- Participation à l’essai IMMUNORARE, qui teste le DOMVANALIMAB et le ZIMBERELIMAB, validée par une Réunion de Concertation Pluridisciplinaire référente pour le cancer rare concerné, reconnue par le Centre National de Reference.
- Pas d’indication de chirurgie curative pour ce cancer au moment de l’inclusion.
- Pour la cohorte 1 uniquement (mésothéliome péritonéal), une chirurgie de réduction pourrait être envisagée après un minimum de 6 mois de traitement à l’étude en cas de réponse tumorale importante.
- Lésions évaluables à l’imagerie (lésions cibles ou non cibles) selon les critères RECIST 1.1 (cohortes 3, 4, 5), ou mRECIST (cohorte 1) ; pour les patientes incluses en cohorte 2 : réponse biologique évaluable par le dosage d’hCG sérique.
- Patients âgés de plus de 18 ans.
- Status de performance ECOG (Eastern Cooperative Oncology Group) ≤ 1.
- Patients ayant consenti à fournir un bloc de tissu tumoral archivé ou des lames pour la recherche, ou à réaliser une nouvelle biopsie en l’absence de contreindication médicale. Si une nouvelle biopsie ou du matériel d’archive n’est pas disponible, l’inclusion du patient doit être discutée et validée avec les coordinateurs de la cohorte.
- Patients ayant une fonction médullaire adéquate mesurée dans les 28 jours précédant l’administration du traitement de l’étude :
- Numération des neutrophiles absolue > 1.5 x 109/L.
- Numération plaquettaire ≥ 100 x 109/L.
- Hémoglobine ≥ 9 g/dL .
- Patients ayant une fonction rénale adéquate : clairance de la créatinine calculée ≥ 30 ml/min selon la méthode standard institutionnelle locale (MDRD de préférence).
- Bilirubine sérique ≤ 1,5 x LSN (< 3 x ULN pour les patients avec syndrome de Gilbert connu), ASAT/ALAT ≤ 2,5 x LSN (≤ 5 x LSN pour les patients avec métastases hépatiques).
- Esperance de vie ≥ 16 semaines.
- Contraception hautement efficace pour les hommes et les femmes en âge de procréer. Les méthodes contraceptives efficaces et les directives à suivre sont décrites dans l’Annexe 1 du protocole.
- Consentement éclairé signé avant de réaliser toute procédure liée à l’étude.
- Patients affiliés au système de sécurité sociale français ou équivalent.
- Patient capable de se conformer au protocole, y compris aux visites de suivi et aux examens.
Critères d’inclusions spécifiques par cohorte :
- Cohorte 1 (mésothéliomes péritonéaux) :
o Mésothéliomes péritonéaux malins confirmés histologiquement (épithélioïdes, sarcomatoïdes ou biphasiques)
o Progression ou récidive après au moins une ligne de chimiothérapie à base de sels de platine et de pémetrexed. Un traitement antérieur par chimiothérapie aéroportée intrapéritonéale sous pression (PIPAC) est autorisé. - Cohorte 2 (tumeurs trophoblastiques germinales) :
o Tumeurs trophoblastiques gestationnelles (y compris les tumeurs trophoblastiques du site placentaire et les carcinomes épithélioïdes) confirmées histologiquement ou cytologiquement par un pathologiste référent du Centre National Français des Maladies Trophoblastiques Gestationnelles. Dans des cas exceptionnels, les patientes présentant une situation clinique typique de tumeurs trophoblastiques gestationnelles avec élévation de l’hCG et résistantes à une poly-chimiothérapie peuvent être incluses, même en l’absence d’une confirmation histologique ou cytologique de tumeur trophoblastique gestationnelle, à condition que le centre national de maladies trophoblastiques gestationnelles ait validé le cas et l’inclusion de la patiente.
o Preuve de résistance ou de rechute après au moins une ligne de polychimiothérapie (par exemple, EP à faible dose, schéma BEP, schéma EMACO, etc.). - Cohorte 3 (Thymomes B3 et carcinomes thymiques) o Thymomes de type B3 et carcinomes thymiques, confirmés histologiquement par un pathologiste référent du réseau RYTHMIC.
o Patient en progression ou en rechute après au moins une ligne de chimiothérapie à base de platine. - Cohorte 4 (Carcinomes thyroïdiens anaplasiques)
o Carcinome thyroïdien anaplasique avec ou sans mutation B-RAF, confirmé histologiquement ou cytologiquement par un pathologiste référent du réseau TUTYREF.
o Pour les carcinomes thyroïdiens anaplasiques avec B-RAF non muté : maladie persistante lors de la première évaluation après chimiothérapieradiothérapie, ou progression/rechute de la maladie après la fin du traitement par chimiothérapie-radiothérapie.
o Pour les carcinomes thyroïdiens anaplasiques avec B-RAF muté : preuve de progression après un traitement par inhibiteur de B-RAF. • Cohorte 5 (GEP-NET et tumeurs carcinoïdes)
o Tumeurs neuroendocrines bien différenciées confirmées histologiquement ou cytologiquement (classification OMS en NET G1, G2 ou G3), ou tumeurs carcinoïdes typiques/atypiques (selon la classification OMS pour les NET thoraciques), d’origine gastro-entéro-pancréatique, thoracique (thymus ou poumon) ou d’origine inconnue.
o Indication de traitement à base d’oxaliplatine.
o Preuve de progression ou de rechute après au moins une ligne de traitement systémique par analogues de la somatostatine, ou par thérapies ciblées tels que l’everolimus ou le sunitinib, ou par chimiothérapie sans oxaliplatine, ou par thérapie par radionucléides à récepteurs peptidiques. - Cohorte 5 (GEP-NET et tumeurs carcinoïdes)
o Tumeurs neuroendocrines bien différenciées confirmées histologiquement ou cytologiquement (classification OMS en NET G1, G2 ou G3), ou tumeurs carcinoïdes typiques/atypiques (selon la classification OMS pour les NET thoraciques), d’origine gastro-entéro-pancréatique, thoracique (thymus ou poumon) ou d’origine inconnue.
o Indication de traitement à base d’oxaliplatine.
o Preuve de progression ou de rechute après au moins une ligne de traitement systémique par analogues de la somatostatine, ou par thérapies ciblées tels que l’everolimus ou le sunitinib, ou par chimiothérapie sans oxaliplatine, ou par thérapie par radionucléides à récepteurs peptidiques.
Critère(s) de non-inclusion
Critères de non-inclusions applicables à toutes les cohortes :
- Traitement antérieur avec des inhibiteurs de points de contrôle immunitaire (y compris anti-TIGIT, anti-PD1, anti-PD-L1, anti-CTLA4) ou d’autres types d’immunothérapie.
- Maladies auto-immunes actives ou antérieures documentées.
Les exceptions à ce critère sont les suivantes : patients avec vitiligo ou alopécie ; patients avec hypothyroïdie (par exemple, suite à un syndrome de Hashimoto) stable sous traitement hormonal ; patients avec des maladies cutanées chroniques ne nécessitant pas de thérapie systémique. Les patients sans signe clinique de la maladie en l’absence de traitement depuis au moins 5 ans peuvent potentiellement être inclus, après discussion avec le coordonnateur de la cohorte. - Présence d’une pathologie nécessitant un traitement stéroïdien systémique chronique ou d’autres médicaments immunosuppresseurs. Par exemple, les patients atteints de maladies auto-immunes nécessitant des stéroïdes systémiques ou des agents d’immunosuppression ne sont pas incluables dans l’étude. Des traitements de substitution (par exemple la thyroxine, ou l’administration de corticostéroïdes à doses physiologiques pour insuffisance surrénalienne ou hypophysaire, etc.) ne sont pas considérés comme une forme de traitement systémique.
- Maladie intercurrente non contrôlée, y compris, mais sans s’y limiter à : insuffisance cardiaque congestive ; détresse respiratoire ; insuffisance hépatique ; allergie ; maladie psychiatrique/situation sociale qui, selon l’investigateur, limiterait le respect des exigences de l’étude, ou qui augmenteraient considerablement le risque d’effets indésirables ou compromettrait la capacité du patient à donner son consentement éclairé par écrit.
- Cancer concomitant, à l’exception des cas suivants : cancer de la peau traité, autre que mélanome, cancer in situ du col de l’utérus traité et considéré guéri, ou autres cancers hématologiques ou solides traités et considérés guéris et ne présentant aucun signe de maladie depuis ≥ 3 ans.
- Patients présentant une atteinte méningée.
- Métastases du système nerveux central (SNC) non traitées ou symptomatiques.
Les patients sont éligibles si les critères suivants sont remplis :
– Les lésions du SNC sont asymptomatiques et ont déjà été traitées.
– Le patient n’a pas besoin d’un traitement stéroïdien continu.
– L’imagerie démontre la stabilité de la maladie 28 jours après le dernier traitement des métastases du SNC. - Patients traités par chimiothérapie systémique ou radiothérapie (sauf pour traitement à visée antalgique ou palliative) dans les 6 semaines précédant la première dose de traitement de l’étude (ou au moins 5 demi-vies en fonction des caractéristiques des traitements administrés). L’administration de bisphosphonates pour le traitement des métastases osseuses est acceptée avant et pendant l’étude, à condition que ceux-ci aient été initiés au moins 4 semaines avant le début des traitements à l’étude.
- Traitement avec d’autres agents expérimentaux susceptibles d’interagir avec les résultats de l’essai, selon l’avis de l’investigateur.
- Syndrome d’occlusion intestinale, maladie inflammatoire de l’intestin, colite immunitaire ou autres troubles gastro-intestinaux provoquant une malabsorption ne permettant pas la prise de médicaments par voie orale.
- Infection active par le VIH, le VHB ou le VHC.
- Patients ayant subi une transplantation d’organe, y compris une transplantation de cellules souches allogéniques (à l’exclusion d’une transplantation autologue de moelle osseuse).
- Participation concomitante à tout autre essai clinique susceptible d’interférer avec la présente étude, selon l’avis de l’investigateur.
- Patients sous tutelle ou curatelle.
Critères de non-inclusions spécifiques par cohorte :
- Cohorte 1 (mésothéliome péritonéal) : chirurgie cytoréductive ou PIPAC prévue pendant les 6 premiers mois de traitement de l’étude (qui aurait un impact sur l’évaluation du critère de jugement principal).
- Cohorte 3 (thymomes B3 et carcinomes thymiques) :
o Tumeurs neuroendocrines.
o Tumeur d’histologie mixte, avec composants A/AB/B2.
o Tout syndrome paranéoplasique.
o Positivité aux anticorps anti RACh. - Cohorte 5 (GEP-NET et tumeurs carcinoïdes) :
o Carcinomes neuroendocrines peu différenciés.
o Tumeurs mixtes.
o Contre-indication au FOLFOX-4 (déficit en DPD, c’est-à-dire taux d’uracilémie ≥ 16 ng/mL).
o Administration antérieure d’oxaliplatine.
Calendrier prévisionnel
Lancement de l’étude : Octobre 2025
Fin estimée des inclusions : Octobre 2028
Nombre de patients à inclure : 131 patients
Au total l’étude devra inclure 131 patients ayant reçu au moins un cycle complet de traitement, n’ayant pas changé de traitement pour des raisons autre que la progression, et évaluables pour le critère d’efficacité :
– Cohorte 1 : Mésothéliomes péritonéaux (MP) : 27 patients
– Cohorte 2 : Tumeurs trophoblastiques germinales (TTG) : 27 patientes
– Cohorte 3 : Thymomes B3 et carcinomes thymiques (TCT) : 26 patients
– Cohorte 4 : Carcinomes thyroïdiens anaplasiques (CTA) : 24 patients
– Cohorte 5 : Tumeurs neuroendocrines gastro-entéro-pancréatiques (GEP-NET) et
tumeurs carcinoïdes (GEP-NET/TCT/UP-NET) : 27 patients
Coordonnateur de l'étude
Pr Benoit YOU – Hospices Civils de Lyon
Promoteur de l'étude
HOSPICES CIVILS DE LYON
