RADIOFAP
Etude pilote évaluant l’association radiofréquence guidée par écho endoscopie et FOLFIRINOX dans les cancers localement avancés
Phase : Sans
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Etablissement(s) participant(s)
Pr Marc Barthet
Détails de l'essai
Objectif principal
Evaluer la faisabilité de la destruction tumorale par radiofréquence couplée au FOLFIRINOX sur la survie sans progression de patients avec ADKp.
Résumé / schéma de l'étude
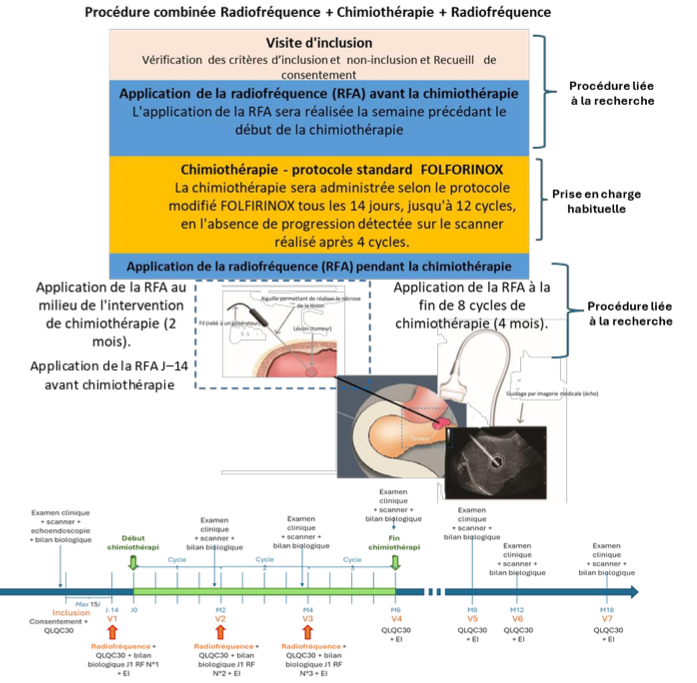
Critère(s) d'inclusion
- Patient de plus de 18 ans.
- Patients atteints d’un adénocarcinome pancréatique localement avancé, difficilement résécable (borderline) ou non opérable, confirmé par des tests histologiques ou cytologiques et évalué après une consultation multidisciplinaire.
- Patient sans métastases.
- Absence de traitement anti-tumoral antérieur.
- Statut de performance de l’OMS ≤ 1.
- Tumeur mesurable selon les critères RECIST v1.1 : lésion tumorale mesurable dont le plus grand diamètre est ≥ 20 mm en utilisant des techniques conventionnelles ou ≥ 10 mm avec un scanner spiralé.
- Patient ayant donné son consentement écrit.
- Patient sans contre-indications à l’anesthésie générale.
- Tumeur pancréatique primitive accessible par écho-endoscopie.
- Patient affilié à un régime de sécurité sociale (bénéficiaire ou ayant droit).
Critère(s) de non-inclusion
- Autre type de tumeur pancréatique non canalaire ou tumeur avec métastases.
- Contre-indication aux traitements (5FU, oxaliplatine, irinotécan).
- Cancer concomitant ou antécédent récent de cancer (hors exceptions).
- Neuropathie préexistante, maladie de Gilbert, ou maladie inflammatoire chronique de l’intestin.
- Contre-indication à la cytoponction sous échoendoscopie.
- Anomalies biologiques : neutropénie, thrombopénie, ictère néoplasique non traité.
- Participation à un autre essai clinique en cours.
- Incapacité à suivre le suivi médical (raisons géographiques, sociales, psychologiques).
- Personnes sous tutelle, privées de liberté, ou ne pouvant donner leur consentement.
- Femmes enceintes, allaitantes, ou souhaitant une grossesse.
- Patients porteurs de dispositifs implantables (stimulateurs, défibrillateurs).
Calendrier prévisionnel
Lancement de l’étude : Avril 2025
Fin estimée des inclusions : Aout 2027
Nombre de patients à inclure : 30
Coordonnateur de l'étude
Pr Marc BARTHET – AP-HM
Promoteur de l'étude
Société Française d’Endoscopie Digestive (SFED)
Dernière mise à jour le 16 juillet 2025
