ORL15 – SURVEILLE HPV
Etude nationale, multicentrique, ouverte, randomisée, de phase II évaluant l’ADN circulant du HPV comme biomarqueur pour détecter la récidive, afin d’améliorer la surveillance post-thérapeutique des cancers de l’oropharynx HPV-induits
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Adjuvant )
Etablissement(s) participant(s)
Détails de l'essai
Objectif principal
Estimer la valeur prédictive négative (VPN) de l’ADN tumoral circulant du HPV à 2 ans dans la détection de la récidive de la maladie au cours de la surveillance chez des patients atteints d’un cancer de l’oropharynx HPV-positifs en rémission complète suite au traitement.
Objectif(s) secondaire(s)
Estimer la valeur prédictive négative (VPN) de l’ADNct du HPV à 3 et 5 ans dans la détection de la récidive du cancer de l’Oropharynx durant la phase de surveillance.
Estimer la valeur prédictive positive (VPP) de l’ADNct du HPV à 2, 3 et 5 ans dans la détection de la récidive du cancer de l’Oropharynx durant la phase de surveillance.
Estimer le taux de récidive détectée en premier par l’ADNct du HPV (sans symptômes cliniques ni d’anomalies lors de l’examen clinique) parmi toutes les récidives.
Evaluer la compliance des stratégies de suivi.
Déterminer si la récidive de la maladie est détectée plus tôt chez les patients randomisés dans le bras expérimental en estimant la survie sans maladie dans chaque groupe.
Comparer la taille/stade de la récidive locorégionale entre les 2 groupes. L’hypothèse est que les récidives locorégionales seraient détectées plus précocement dans le groupe expérimental.
Comparer le délai d’apparition, la taille et le nombre des récidives à distance entres les 2 groupes. L’hypothèse est que les récidives à distances seraient moins nombreuses et/ou détectées plus tôt dans le groupe expérimental.
Etudier la survie globale dans les 2 groupes.
Réaliser une évaluation économique incluant une analyse coût-conséquence, une analyse sur l’impact budgétaire et organisationnel.
Evaluer l’impact pronostic du taux d’ADNct du HPV avant l’initiation du traitement anticancéreux : association avec le stade, la réponse tumorale à la baseline, la survie globale, la survie sans maladie et l’incidence des rechutes locorégionales et à distance.
Décrire l’évolution du taux d’ADNct du HPV entre le début et la fin du traitement et étudier sa valeur pronostic sur la survie globale, la survie sans maladie et l’incidence des rechutes locorégionales et à distance.
Résumé / schéma de l'étude
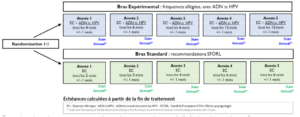
Il s’agit d’une étude multicentrique, randomisée et ouverte de phase 2 comparant la stratégie de surveillance post-thérapeutique standard (recommandée par la SFORL) à une nouvelle stratégie de surveillance allégée associée à un dosage de l’ADNct du HPV réalisé par la méthode Droplet Digital PCR (ddPCR) à chaque visite. Après la fin du traitement, les patients des groupes A, B1 et C1 seront considérés comme répondeurs et seront randomisés dans l’un des deux bras de l’étude :

330 patients atteints d’un cancer de l’oropharynx HPV-positif avec un niveau détectable d’ADNct du HPV avant le traitement et qui sont complètement répondeurs lors de la première évaluation post-thérapeutique seront randomisés (1:1) dans :
Groupe témoin : Suivi standard.
Groupe expérimental : Fréquence allégée des visites de suivi, avec dosage de l’ADN circulant du HPV à chaque visite.
Critère(s) d'inclusion
Phase de sélection :
- Le patient doit avoir signé un premier formulaire de consentement éclairé avant la visite de dépistage et avant toute procédure spécifique à l’essai. Si le patient est physiquement incapable de donner son consentement écrit, une personne de confiance de son choix, n’ayant aucun lien avec l’investigateur ou le promoteur, peut confirmer par écrit le consentement du patient.
- Age ≥ 18 ans.
- Patients présentant un carcinome épidermoïde de l’oropharynx histologiquement prouvé.
- Tumeur p16 positive par IHC (immunohistochimie).
- TNM clinique T1-4, N0-3, M0 (stades I-III).
- Eligible à un traitement anticancéreux.
- Patients affiliés à un régime de sécurité sociale ou bénéficiaire d’un tel régime.
- Patient désireux et capable de se conformer au protocole pendant la durée de l’étude, y compris le traitement, les visites et les examens programmés tout au long de l’étude, ainsi que le suivi.
- Patient consent à l’utilisation de ses échantillons de tumeurs collectés, ainsi que des échantillons de sang comme détaillé dans le protocole pour la caractérisation de la tumeur et le dosage de l’ADNc du HPV.
Phase de randomisation :
- Le patient doit avoir signé un consentement éclairé avant la phase de randomisation. Si le patient est physiquement incapable de donner son consentement écrit, une personne de confiance de son choix, n’ayant aucun lien avec l’investigateur ou le promoteur, peut confirmer par écrit le consentement du patient.
- Statut HPV positif prouvé par PCR sur la tumeur initiale avant la randomisation.
- Dosage de l’ADNct du HPV positif (par Droplet digital PCR) avant le traitement anticancéreux curatif.
- Patients en rémission complète de 2 à 4 mois après la fin de traitement prouvé par imagerie (scanner ou IRM de la tête et du cou, scanner thoracique et TEP-scanner) et un dosage de l’ADNct du HPV négatif, ce qui signifie :
- ADNct du HPV indétectable et absence de maladie résiduelle à l’imagerie (groupe A).
- ADNct du HPV indétectable et imagerie suspecte mais maladie résiduelle exclue par biopsie ou par imagerie répétée et par un nouveau dosage d’ADNct du HPV. Cette seconde évaluation sera réalisée 2 mois après la première (groupe B1).
- ADNct du HPV positif et absence de récidive à l’imagerie, mais ADNct du HPV négatif lors du dosage répété. Ce deuxième test sera effectué 2 mois après le premier (groupe C1).
- Score de performance ECOG 0-2.
- Patients affiliés à un régime de sécurité sociale ou bénéficiaire d’un tel régime.
- Patients désireux et capable de se conformer au protocole pendant la durée de l’étude, y compris les visites et les examens programmés tout au long du suivi.
- Le patient consent à l’utilisation de ses échantillons de tumeurs collectés, ainsi que des échantillons de sang comme détaillé dans le protocole à des fins de recherche scientifique future, y compris, mais sans s’y limiter, la détection de biomarqueurs à base d’ADN, d’ARN et de protéines.
Critère(s) de non-inclusion
Pour les deux phases (phases de sélection et de randomisation)
- Traitement antérieur pour le cancer étudié (une chimiothérapie antérieure pour un autre cancer est autorisée).
- Maladie intercurrente non contrôlée qui limiterait le respect des exigences de l’étude.
- Autre tumeur maligne présente ou antérieure au cours des 3 années précédentes (sauf carcinome à cellules squameuses cutané ou d’un carcinome in situ traité par chirurgie).
- Tout autre cancer induit par le HPV au cours des 5 dernières années.
- Cancer H&N antérieur ou radiothérapie H&N antérieure.
- Tout(s) facteur(s) social(aux), personnel(s), géographique(s), médical(aux) et / ou psychologique(s) pouvant interférer avec l’observance du patient au protocole et / ou le suivi. Ces conditions doivent être discutées avant l’inclusion du patient.
- Personne privée de liberté ou faisant l’objet d’une mesure de protection juridique ou incapable de donner son consentement.
Calendrier prévisionnel
Lancement de l’étude : Avril 2024
Fin estimée des inclusions : Avril 2028
Nombre des patients à inclure : 420 inclusions / 330 patients randomisés
Coordonnateur de l'étude
Pr Haitham MIRGHANI
Hôpital Européen Georges Pompidou – AP-HP
Promoteur de l'étude
UNICANCER
