IFCT-2202 ROSIE
Etude de cohorte prospective évaluant les facteurs moléculaires de pronostic et mécanismes de résistance à l’osimertinib dans le traitement adjuvant du carcinome pulmonaire non à petites cellules pIB-IIIA complètement réséqué avec mutation commune de l’EGFR (L858R et Del19)
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Adjuvant )
Cibles / marqueurs : EGFR
Etablissement(s) participant(s)
Dr Jonathan BENZAQUEN
Pr Pascale TOMASINI
Dr Clarisse AUDIGIER-VALETTE
Détails de l'essai
Objectif principal
1 ère étape : 80 patients
Faisabilité de l’étude (nombre de patients inclus recevant l’osimertinib après 18 mois d’inclusion).
2 ème étape : 300 patients (incluant les 80 patients de la faisabilité)
Description des caractéristiques pronostiques cliniques, pathologiques et moléculaires à l’inclusion associées à la survie sans récidive des patients ayant un CBNPC de stade pIB-IIIA (TNM 8ème édition) complètement réséqué ayant une mutation commune de l’EGFR (Del19 ou L858R) après traitement par l’osimertinib.
Objectif(s) secondaire(s)
Description des caractéristiques pronostiques cliniques, pathologiques et moléculaires associées à la survie après traitement par l’osimertinib.
Description des altérations moléculaires lors de la rechute clinique/radiologique.
Evaluation de l’ADNct à l’inclusion et pour la détection précoce des rechutes.
Evaluation de la sécurité de l’osimertinib.
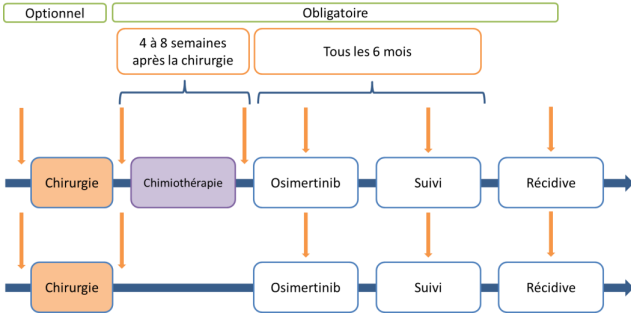
Résumé / schéma de l'étude
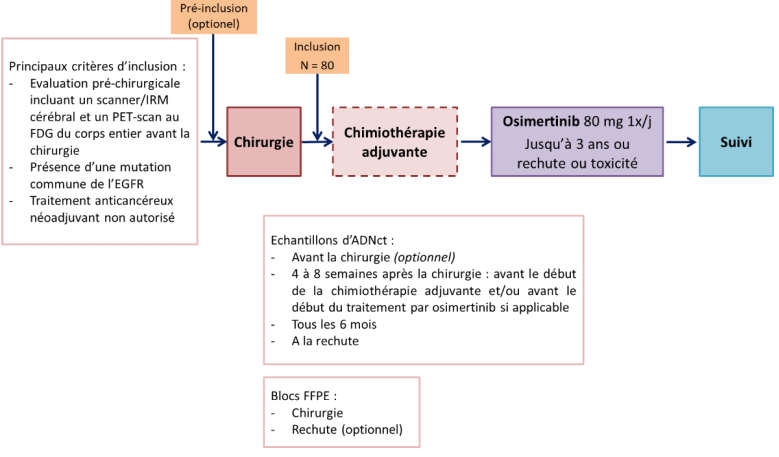
Critère(s) d'inclusion
Critères de pré-inclusion avant la chirurgie (optionnel)
- Consentement éclairé, écrit et signé : Les patients doivent avoir signé et daté le formulaire de consentement éclairé écrit approuvé par le comité d’éthique en accord avec le cadre juridique et institutionnel. Il doit avoir été signé avant que des procédures liées au protocole ne faisant pas partie de la prise en charge standard des patients soient réalisées.
- Age ≥ 18 ans.
- Evaluation pré-chirurgicale incluant un scanner/IRM cérébral et un TEP-scan au FDG du corps entier avant la chirurgie.
- CBNPC résécable et opérable confirmé histologiquement ou cytologiquement de stade cIB-IIIA (pTNM 8ème édition).
- Présence d’une mutation commune de l’EGFR (Del19 ou L858R).
Critères d’inclusion
- Consentement éclairé, écrit et signé : Les patients doivent avoir signé et daté le formulaire de consentement éclairé écrit approuvé par le comité d’éthique en accord avec le cadre juridique et institutionnel. Il doit avoir été signé avant que des procédures liées au protocole ne faisant pas partie de la prise en charge standard des patients soient réalisées.
- Age ≥ 18 ans.
- Evaluation pré-chirurgicale incluant un scanner/IRM cérébral et un PET-scan au FDG du corps entier avant la chirurgie.
- CBNPC complètement réséqué (R0) confirmé histologiquement de stade pIB à IIIA (TNM 8ème édition).
- Présence d’une mutation commune de l’EGFR (Del19 ou L858R).
- Tissus tumoral archivé (bloc FFPE) provenant de la chirurgie disponible pour des analyses moléculaires centralisées.
- Patients éligibles pour recevoir un traitement adjuvant par osimertinib de 3 ans. Les patients peuvent recevoir si nécessaire une chimiothérapie adjuvante avant de débuter le traitement par osimertinib. Cependant, les patients ayant reçu de l’osimertinib et/ou une chimiothérapie néoadjuvante et/ou un autre traitement anticancéreux ne sont pas éligibles (y compris la chimiothérapie adjuvante).
- Patient capable, selon l’investigateur, de se conformer aux exigences et aux restrictions de l’étude.
- Patient suivi dans le centre sur une base régulière (tous les 3 à 6 mois) selon les recommandations standard.
- Espérance de vie > 3 ans.
- Les femmes qui sont susceptibles de procréer sont éligibles à condition : d’avoir un test de grossesse négatif avant la 1ère dose d’osimertinib et d’accepter d’utiliser des méthodes de contraception efficaces pendant toute la durée de l’étude et doivent être maintenues pendant 2 mois après la fin du traitement.
- Les hommes sexuellement actifs avec une femme susceptible de procréer sont éligibles si une méthode de contraception efficace est utilisée pendant la durée de l’étude et jusqu’à 4 mois après la dernière dose.
Critère(s) de non-inclusion
- Antécédents de cancer. Les patients ayant un antécédent de cancer de plus de trois ans sont éligibles s’ils sont traités et considérés comme guéris. Les patients ayant des antécédents de carcinome in situ du col de l’utérus ou de carcinome de la peau non mélanome sont éligibles.
- Traitement anticancéreux néoadjuvant.
- Résection incomplète du CBNPC (R1 ou R2).
- Toute condition médicale qui selon l’investigateur empêcherait la participation du patient à l’étude clinique.
- Infection active (par exemple, patient recevant un traitement pour une infection), y compris le virus de l’hépatite C (VHC) et le virus de l’immunodéficience humaine (VIH) ou infection active non contrôlée par le virus de l’hépatite B (VHB). Le dépistage de ces maladies n’est pas nécessaire.
Calendrier prévisionnel
Lancement de l’étude : Septembre 2023
Fin estimée des inclusions : Mars 2025
Nombre de patients à inclure : 300
Information(s) complémentaire(s)
BIO-IFCT-2202
Prélèvements tissulaires
Tissus tumoral archivé provenant de la chirurgie disponible pour des analyses moléculaires centralisées : bloc FFPE représentatif (recommandé) ou 20 lames de 5 µm.
Tissus tumoral archivé à la rechute : bloc FFPE (recommandé) ou 10 lames de 4-6 µm.
Prélèvements sanguins
Coordonnateur de l'étude
Pr Jacques CADRANELN
Hôpital Tenon (AP-HP)
Promoteur de l'étude
Intergroupe Francophone de Cancérologie Thoracique (IFCT)
