HEROES
Désescalade des traitements médicaux dans les cancers du sein métastatiques HER2 positif en cas de réponse persistante à long terme et de maladie résiduelle minime indétectable évaluée par ADN tumoral circulant
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Cibles / marqueurs : HER2+
Etablissement(s) participant(s)
Détails de l'essai
Objectif principal
L’objectif principal de l’étude HEROES est d’évaluer la faisabilité d’une désescalade thérapeutique (arrêt temporaire ou complet) chez des patients ayant un cancer du sein métastatique HER2-positif dont la maladie est contrôlée après 2 ans de traitement d’entretien avec une thérapie ciblée anti-HER2 ET un test ADNtc négatif.
Objectif(s) secondaire(s)
Survie sans progression (PFS).
Dynamique de l’ADNtc et le taux de positivité.
Durée de réponse (DoR).
Survie globale (OS).
Réponse moléculaire.
Qualité de Vie.
Résumé / schéma de l'étude
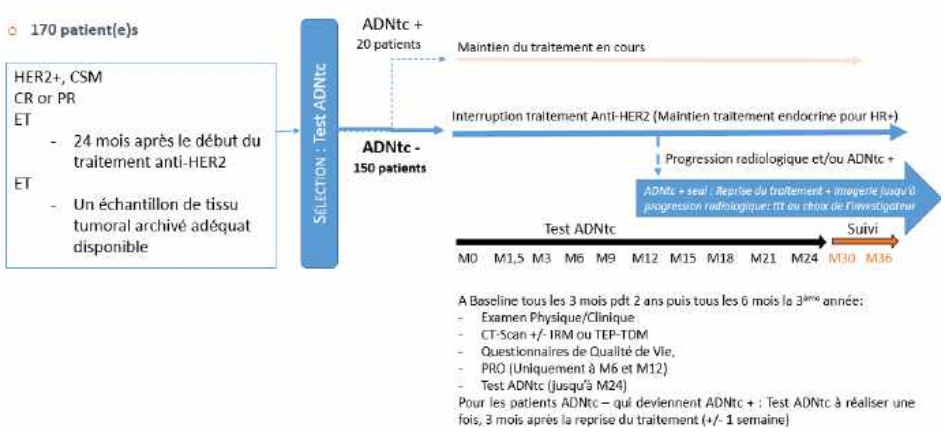
Critère(s) d'inclusion
Principaux critères :
- Diagnostic documenté de cancer du sein localement avancé, inopérable ou métastatique histologiquement prouvé HER2 positif (HER2-positif est défini comme une surexpression immunohistochimique HER2 3+, ou la présence d’une amplification HER2, selon les lignes directrices de l’ASCO-CAP).
- Traitement précédent par thérapie ciblée anti-HER2 continue (y compris Trastuzumab, Trastuzumab/Pertuzumab, Trastuzumab-Deruxtecan ou T-DM1) pendant au moins 2 ans, quelle que soit la ligne de traitement, pour son cancer du sein HER2 + localement avancé, inopérable ou métastatique (une interruption préalable du traitement de 3 mois maximum est autorisée), avec une réponse complète ou une réponse partielle lors de la dernière évaluation radiologique Note : le nombre de patients ayant reçu une thérapie ciblée anti-HER2 en deuxième ligne ou plus sera limité à 50 % de la population totale.
- En cas de maladie osseuse uniquement, une réponse métabolique complète au pet-scanner 18-FDG est requise.
- Patient dont la tumeur primaire a été traitée (chirurgie et/ou radiothérapie) et contrôlée.
- Les patientes atteintes d’une maladie RE positive peuvent ou non avoir reçu un traitement endocrinien concomitant (qui doit être poursuivi s’il est présent). Le blocage ovarien concomitant à l’aide d’agonistes de l’hormone de libération de la lutéostimuline (LHRH) est également autorisé.
Critère(s) de non-inclusion
Principaux critères :
- Toute progression du cancer du sein au cours des 2 dernières années ou à l’entrée dans l’étude.
- Patient utilisant simultanément d’autres agents antinéoplasiques approuvés ou expérimentaux que le trastuzumab, le pertuzumab, le Trastuzumab-Deruxtecan, le TDM-1 +/- une thérapie endocrinienne.
- Avoir des antécédents de méningite tumorale ou de métastases du système nerveux central cliniquement actives, définies comme non traitées ou symptomatiques, ou nécessitant un traitement par corticostéroïdes ou anticonvulsivants pour contrôler les symptômes associés.
- Les sujets présentant des métastases cérébrales traitées de manière curative (c’est-à-dire chirurgie d’exérèse complète ou radiothérapie stéréotaxique) qui ne sont plus symptomatiques et ne nécessitent pas de traitement par corticostéroïdes ou anticonvulsivants peuvent être inclus dans l’étude à condition qu’ils se soient remis de la toxicité aiguë de la radiothérapie et qu’il n’y ait pas eu de progression des métastases cérébrales au cours des 24 derniers mois.
- Les sujets présentant uniquement des métastases cérébrales ou traités par radiothérapie de l’ensemble du cerveau seront exclus de l’étude.
- Antécédents de cancer du sein ipsi ou controlatéral (sauf en cas de DCIS), sauf si les deux tumeurs primaires ont été confirmées comme étant HER2 positives.
Calendrier prévisionnel
Lancement de l’étude : Janvier 2025
Fin estimée des inclusions : Novembre 2027
Nombre de patients à inclure : 170
Coordonnateur de l'étude
Dr. Thibault de la Motte Rouge – Centre Eugène Marquis – CLCC Rennes
Promoteur de l'étude
UNICANCER
