UNLOCK TARLATAMAB
Etude de plateforme de phase II, multicentrique, ouverte, investiguant le tarlatamab (AMG 757) chez des patients atteints de cancer du poumon à petites cellules (SCLC) métastatique/localement avancé et d’autres carcinomes neuroendocriniens peu différenciés (NEC), avec analyse des biomarqueurs pour caractériser la réponse/résistance
Phase : II
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Cibles / marqueurs : DLL3+
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Métastatique / Rechute , Localement avancée / Non résécable )
Cibles / marqueurs : DLL3+
Etablissement(s) participant(s)
Dr Victoria FERRARI
Détails de l'essai
Objectif principal
Evaluer le taux de réponse objective (ORR) à 4 mois.
Objectif(s) secondaire(s)
Evaluer l’efficacité du tarlatamab, sur la base de l’évaluation de l’investigateur.
Evaluer la sécurité et la tolérabilité du tarlatamab.
Résumé / schéma de l'étude
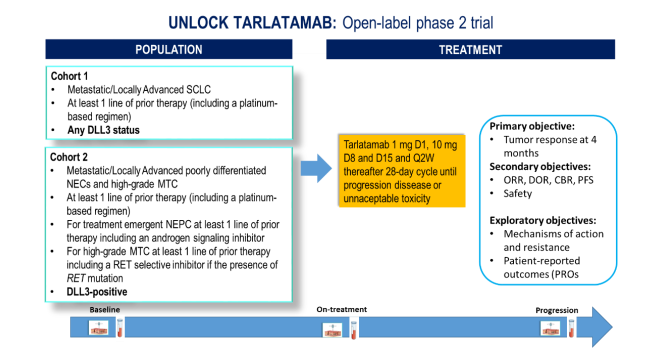
Critère(s) d'inclusion
Principaux critères d’inclusion :
- Patients âgés de 18 ans ou plus
- Patients atteints d’un SCLC métastatique/localement avancé confirmé histologiquement ou d’autres NEC peu différenciés DLL3-positifs, sont éligibles.
- Les patients doivent avoir reçu au moins une ligne de traitement préalable, y compris un régime à base de platine (sauf en cas de NEPC en situation d’urgence thérapeutique), et aucune option thérapeutique standard ne doit être disponible.
- Les patients atteints d’un carcinome médullaire de la thyroïde (MTC) métastatique/localement avancé de haut grade, qui doivent avoir reçu au moins une ligne de traitement préalable, y compris un inhibiteur sélectif de RET en cas de mutation de RET, seront également éligibles. Le nombre de patients atteints d’un carcinome thyroïdien de haut grade avancé est limité à 4 patients.
- Les patients doivent avoir une fonction organique adéquate et un site tumoral facilement accessible pour la biopsie, en évitant si possible la biopsie osseuse.
- Les patients seront exclus s’ils ont déjà été traités par tarlatamab, s’ils ont présenté une pneumopathie récurrente (grade≥2) ou des effets indésirables à médiation immunitaire graves et potentiellement mortels, s’ils présentent des métastases cérébrales actives, s’ils souffrent d’une maladie cardiovasculaire non contrôlée, s’ils présentent des troubles auto-immuns ou inflammatoires actifs ou déjà documentés ou s’ils ont reçu un diagnostic d’immunodéficience.
Critère(s) de non-inclusion
Principaux critères d’exclusion :
- Patients éligibles à un traitement curatif.
- Patients atteints de tumeurs neuroendocrines bien différenciées, quel que soit le grade, phéocromocytome, paraganglyome ou MTC de bas grade.
- Signes de pneumopathie interstitielle diffuse ou suspicion à l’imagerie.
- Antécédents de pneumopathie récurrente ≥ grade 2, effets indésirables immuno graves ou réactions liées à la perfusion ayant conduit à un arrêt définitif d’immunothérapie.
- Périodes de sevrage thérapeutique insuffisantes avant C1J1.
- Traitement antérieur par tarlatamab ou inhibiteur DLL3.
- Preuve de compression médullaire ou de métastases cérébrales, définies comme étant cliniquement actives et symptomatiques, ou nécessitant un traitement par corticoïdes ou anticonvulsivants pour contrôler les symptômes associés. Les patients présentant des métastases cérébrales cliniquement inactives ou traitées et asymptomatiques (c’est-à-dire sans signes ni symptômes neurologiques et ne nécessitant pas de traitement par corticoïdes ou anticonvulsivants) peuvent être inclus dans l’étude. L’état neurologique des patients doit être stable depuis au moins deux semaines avant le premier jour du cycle 1.
- Maladie leptoméningée.
- Épanchement pleural cliniquement significatif.
- Thrombose artérielle récente (< 12 mois).
Calendrier prévisionnel
Lancement de l’étude : Juin 2025
Fin estimée des inclusions : Avril 2027
Nombre de patients à inclure : 40
Information(s) complémentaire(s)
Essai industriel.
Pour tout renseignement complémentaire contacter le promoteur.
Informations : Clinicaltrials.gov.
Coordonnateur de l'étude
Dr Yohann LORIOT – Gustave Roussy – CLCC Villejuif
Promoteur de l'étude
Gustave Roussy – CLCC Villejuif
Dernière mise à jour le 20 novembre 2025
