TORPHYNX
Etude prospective comparative non randomisée entre IMRT et chirurgie transorale première dans le traitement des carcinomes épidermoïdes de stade local précoce de l’oropharynx
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Situation thérapeutique : Tumeur solide ( Adjuvant , Chirurgie )
Etablissement(s) participant(s)
Pr Alexandre BOZEC
Dr Nicolas FAKHRY
Détails de l'essai
Objectif principal
L’objectif principal est la déglutition 2 ans après le début du traitement, évalué par le score du MD Anderson Dysphagia Inventory (MDADI).
Objectif(s) secondaire(s)
Les objectifs secondaires sont :
– la survie globale,
– la survie sans récidive,
– le taux d’échec locorégional,
– la qualité de vie évaluée par questionnaires EORTC-QLQC30 et -HN35,
– les taux de trachéotomie et de nutrition entérale,
– la toxicité,
– et une étude médico-économique en deux phases : une étude de microcosting du coût hospitalier de la chirurgie transorale, et une étude comparative du ratio coût-utilité entre les deux stratégies pour le système de santé par une évaluation en QALY.
Résumé / schéma de l'étude
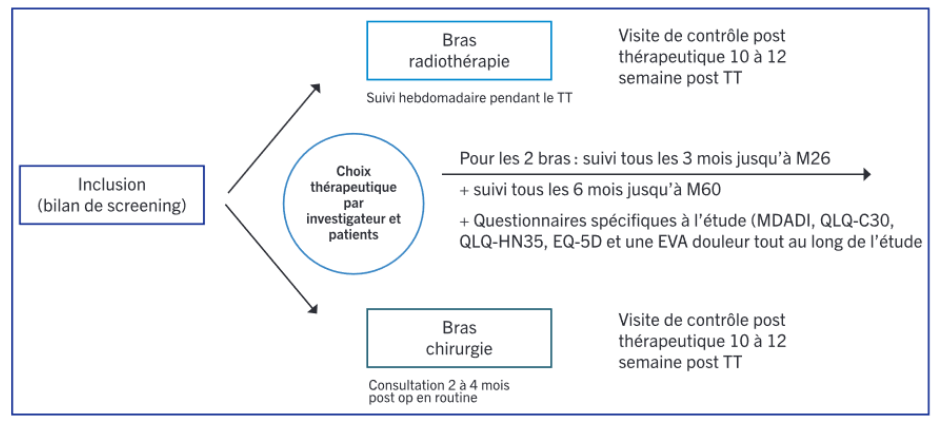
Critère(s) d'inclusion
- Âge ≥ 18 ans.
- Statut de performance ECOG 0-2.
- Carcinome épidermoïde confirmé histologiquement.
- Localisation primitive de l’oropharynx sur la loge amygdalienne ou la base de la langue.
- Statut p16 ou HPV disponible.
- Classification TNM AJCC7th T1 ou T2.
- Classification TNM AJCC7th N0 ou N1.
- Patient et tumeur pouvant être traités par radiothérapie ou par chirurgie transorale.
- Le patient ne s’est pas opposé à sa participation après avoir été informé de l’étude. Le patient doit être capable et désireux de coopérer au suivi et aux visites de l’étude.
Critère(s) de non-inclusion
- Comorbidité médicale grave ou autre contre-indication à la radiothérapie ou à la chirurgie.
- Tumeur primaire ou lymphadénopathie non résécable.
- Maladie métastatique.
- Antécédents de carcinome épidermoïde de la tête et du cou au cours des 5 dernières années.
- Antécédents de radiothérapie de la tête et du cou.
- Incapacité de se soumettre à des consultations de suivi de radiothérapie ou de les mener à bien.
- Antécédents de cancer, sauf absence de maladie depuis au moins 5 ans, à l’exception des cancers de la peau non mélanomateux.
- Incapacité à remplir les questionnaires.
- Femme enceinte ou allaitante.
- Patient sous tutelle ou curatelle, privé de liberté ou dans l’incapacité d’exprimer son consentement.
Calendrier prévisionnel
Lancement de l’étude : Juin 2018
Fin estimée des inclusions : Juin 2031
Nombre de patients à inclure : 150
Coordonnateur de l'étude
Dr Philippe GORPHE – Gustave Roussy – CLCC Villejuif
Promoteur de l'étude
Gustave Roussy – CLCC Villejuif
