Phase : II, Précoce
Type d'essai : Académique / Institutionnel
Etat de l'essai : Ouvert
Objectif principal
Partie A :
Détermination de la dose optimale.
Déterminer la dose optimale en termes de toxicité et d’efficacité de l’association luspatercept+EPO chez les patients SMD de faible risque selon la classification IPSS non sidéroblastique en échec d’EPO ou en rechute après EPO mais sans progression de la maladie.
Partie B :
Bénéfice de l'association par rapport à la monothérapie.
Déterminer, à la semaine 25 (6 mois), la supériorité et l’efficacité (indépendance transfusionnelle chez les patients dépendants transfusionnels et amélioration hématologique pour les patients non dépendant des transfusions) de l’association luspatercept+EPO par rapport à luspatercept seul chez les patients SMD de faible risque selon la classification IPSS non sidéroblastique en échec d’EPO ou en rechute après EPO mais sans progression de la maladie.
Objectifs secondaires
Déterminer le taux de réponse (RC + RP + maladie stable avec amélioration hématologique selon les critères IWG 2006) dans chaque bras.
Déterminer la durée de la réponse jusqu’à la progression et la perte de l’indépendance transfusionnelle chez les patients répondeurs.
Déterminer le taux et le délai de transformation en LAM.
Déterminer la survie globale.
Identifier les facteurs pronostics et prédictifs de réponse, incluant l’IPSS-R, l’IPSS, le caryotype et les mutations somatiques.
Déterminer La tolérance et le profil de toxicité mesurés selon les CTCAE V5.0.
Résumé / Schéma de l'étude
Partie A : Cohorte d'escalade de dose pour déterminer la combinaison la plus prometteuse de Luspatercept et d’Epoïétine alfa (déterminaison de la DLT).
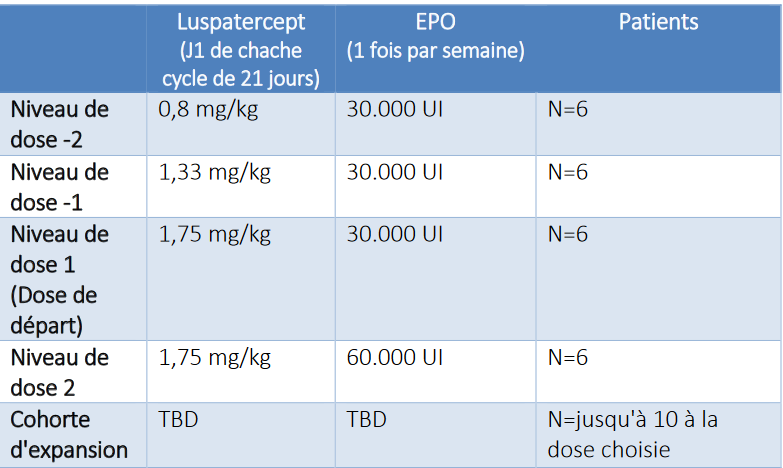
Partie B :
Randomisation 1 :1 à la dose sélectionnée en partie A. Les patients seront randomisés soit dans le bras Luspatercept seul (Bras A) ou en association avec de l’Epoïétine alfa (Bras B).
Les patients recevront Luspatercept par vous sous-cutanée 1 fois tous les 21 jours, seul ou en association avec de l’Epoïétine alfa administrée par voie sous-cutanée 1 fois par semaine, pendant 24 mois.
Les patients répondeurs et qui tolèrent le Luspatercept peuvent poursuivre le traitement jusqu'à la fin de l'essai.
Critères d'inclusion
- Syndrome myélodysplasique selon la classification OMS actuelle.
- Âge ≥ 18 ans.
- Patient avec un SMD de bas risque selon la classification IPSS (low, Int- 1) non sidéroblastique en échec d’ASE ou en rechute après ASE (au moins 12 semaines d’Epoïétine alfa à 60000UI ou équivalent) sans progression de la maladie, ou inéligible aux ASE (défini par taux d’EPO > 500UI/L).
- Hb < 9g/dL ou dépendance transfusionnelle (au moins 3 CG dans une période de 16 semaines et au moins 2 épisodes de transfusions durant cette période).
- SMD non del(5q).
- Fonction rénale adéquate définie par un taux de créatinine inférieure à 1.5 fois la normale supérieure et clairance de la créatinine≥ 40mL/min (selon formule MDRD).
- Fonction hépatique adéquate définie par un taux de bilirubine totale et de transaminases inférieurs à 1.5 fois la normale supérieure.
- Patient non réfractaire aux transfusions de plaquettes.
- Consentement écrit.
- Le patient doit comprendre et signer volontairement le consentement éclairé.
- Le patient doit être capable de respecter le calendrier des visites protocolaires prévues dans le cadre de l’étude et suivre les exigences du protocole.
- ECOG 0- 2 au moment du screening.
- Pour cette étude, une femme en âge de procréer est définie comme une femme sexuellement mature qui :
- N’a pas subi d’hystérectomie et d’ovariectomie bilatérale OU
- N’est pas naturellement ménopausée (Une aménorrhée consécutive à un traitement anti-cancéreux n’exclut pas la possibilité de procréer) depuis au moins 24 mois consécutifs (c’est-à-dire qu’elle a eu des menstruations à un moment quelconque au cours des 24 précédents mois).
- Une femme en âge de procréer participant à l’étude doit :
- Avoir eu 2 tests de grossesse négatifs avant le début du traitement protocolaire (sauf si le test de grossesse a été fait dans les 72h avant le jour 1 du cycle 1). Elle doit accepter de réaliser des tests de grossesse mensuels durant l’étude et après la sortie d’essai.
- Si la patiente est sexuellement active, elle doit accepter d’utiliser et de respecter une contraception hautement efficace** sans interruption, 5 semaines avant le début du traitement protocolaire, pendant le traitement protocolaire (y compris pendant les interruptions de traitement) et pendant 12 semaines après l’arrêt du traitement protocolaire. ** Dans le cadre du protocole, une contraception hautement efficace est définie comme suit (information figurant également dans le consentement) : contraception hormonale (par exemple : pilule contraceptive, injection, implant, patch transdermique, anneau vaginal), dispositif intra-utérin, ligature des trompes ou partenaire ayant subi une vasectomie Les hommes doivent accepter d’utiliser un préservatif, défini comme un préservatif masculin en latex ou un préservatif masculin sans latex NON fabriqué à partir d’une membrane naturelle (animale) (par exemple, le polyuréthane), lors de chaque rapport sexuel avec une femme enceinte ou en âge de procréer pendant toute la durée du traitement, pendant les interruptions de traitement et pendant au moins 12 semaines après l’arrêt du traitement, même s’il a subi une vasectomie.
Critères de non-inclusion
- Infection sévère ou toute autre affection sévère non contrôlée.
- Hypertension non contrôlée.
- Maladie cardiaque significative – Classe NYHA III ou IV ou infarctus du myocarde au cours des 6 derniers mois.
- Syndrome del(5q).
- Utilisation d’agents en cours d’investigation dans les 30 jours ou de tout agent anticancéreux (incluant les IMID) dans les 2 semaines précédant l’inclusion, à l’exception de l’hydroyurée. Le patient doit avoir récupéré (grade≤1) de toutes les toxicités induites par un traitement préalable.
- Utilisation d’EPO dans les 4 semaines précédent l’inclusion.
- Cancer actif ou cancer au cours de l’année précédant l’entrée dans l’essai, exceptés les carcinomes basocellulaires et les carcinomes in situ du col de l’utérus ou du sein.
- Patient déjà inclus dans un essai thérapeutique avec une molécule expérimentale.
- Infection connue par le VIH ou hépatite B ou hépatite C active.
- Femmes enceintes ou allaitantes.
- Toute affection médicale ou psychiatrique ne permettant pas au patient de comprendre ou de signer le consentement éclairé.
- Patient éligible à une allogreffe de cellules souches hématopoïétiques.
- Allergies connues à luspatercept, à l’EPO ou à un de leurs excipients.
- Absence de couverture sociale.
Calendrier prévisionnel
Lancement de l'étude : Mai 2022
Fin estimée des inclusions : Mai 2025
Nombre de patients à inclure : 150
Etablissement(s) participant(s)
> CHU de Nice
(06) Alpes-Maritimes
Pr. Thomas CLUZEAU
Investigateur principal
> Institut Paoli-Calmettes (IPC)
(13) Bouches-du-Rhône
Pr. Norbert VEY
Investigateur principal
> Centre Hospitalier d'Avignon Henri Duffaut
(84) Vaucluse
Dr. Borhane SLAMA
Investigateur principal
Coordonnateur(s)
Pr. Lionel ADÈS
Hôpital Saint Louis - AP-HPPromoteur(s)
Groupe Francophone des Myélodysplasies (GFM)
Dernière mise à jour le 04 mai 2023
